2014年度藥品審評(píng)報(bào)告
國家食品藥品監(jiān)督管理局藥品審評(píng)中心
2014年,國家食品藥品監(jiān)督管理總局藥品審評(píng)中心(以下簡稱藥審中心)在國家食品藥品監(jiān)督管理總局的領(lǐng)導(dǎo)下,繼續(xù)秉持質(zhì)量、公平、效率的原則,圍繞完善國家藥品審評(píng)管理體系建設(shè)推進(jìn)改革,堅(jiān)持依法依規(guī)、科學(xué)規(guī)范審評(píng),不斷提高審評(píng)質(zhì)量和效率,維護(hù)和促進(jìn)公眾健康。根據(jù)國家食品藥品監(jiān)督管理總局有關(guān)工作要求,現(xiàn)將《2014年度藥品審評(píng)報(bào)告》呈現(xiàn)給公眾。
一、2014年藥品審評(píng)基本情況
(一)機(jī)構(gòu)基本情況
藥審中心是國家食品藥品監(jiān)督管理總局藥品注冊(cè)技術(shù)審評(píng)機(jī)構(gòu),負(fù)責(zé)對(duì)藥品注冊(cè)申請(qǐng)進(jìn)行技術(shù)審評(píng)。藥審中心下設(shè)13個(gè)職能部門,其中9個(gè)為技術(shù)審評(píng)部門;全中心在編115人,技術(shù)審評(píng)崗位人員89人。技術(shù)審評(píng)崗位人員正高職稱48人,副高職稱31人,平均年齡45歲;高級(jí)審評(píng)員68人,其中具有主審審評(píng)員資格人員65人,平均審評(píng)工作年限14年。截至2014年底,藥審中心待審評(píng)任務(wù)總量達(dá)到18597個(gè),同比2013年底,待審評(píng)任務(wù)總量增加了4362個(gè)。
(二)審評(píng)任務(wù)接收情況
2014年,藥審中心接收新的注冊(cè)申請(qǐng)8868個(gè)(以受理號(hào)計(jì),下同)。與既往年度接收注冊(cè)申請(qǐng)的比較情況見圖1。
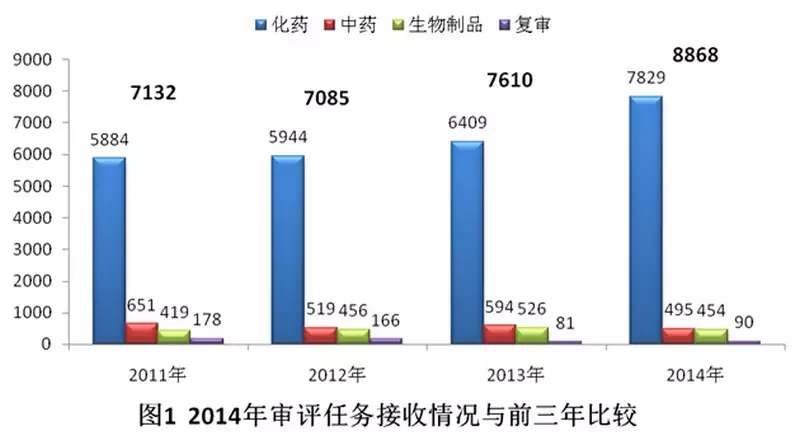
2014年化藥審評(píng)任務(wù)接收量增加明顯,較2011-2013年年均化藥審評(píng)任務(wù)接收量增幅近30%,占年度審評(píng)任務(wù)接收總量近90%;中藥和生物制品審評(píng)任務(wù)的接收量均有所下降。
1.化藥審評(píng)任務(wù)接收情況
(1)化藥審評(píng)任務(wù)分類情況
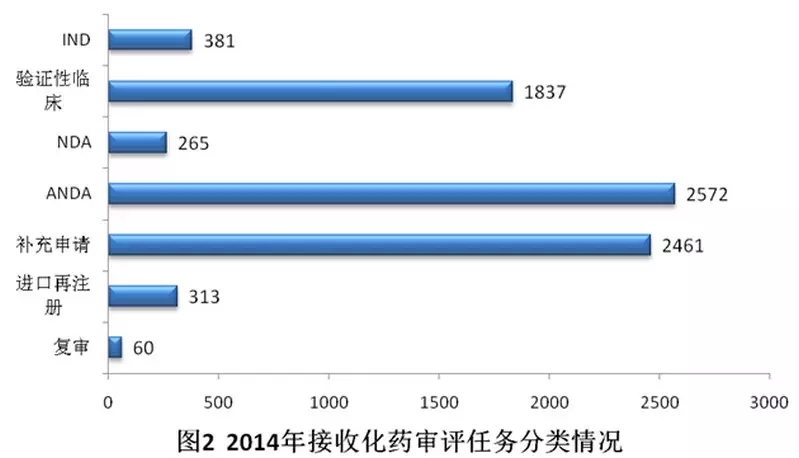
化藥審評(píng)任務(wù)接收分類情況如圖2。其中驗(yàn)證性臨床申請(qǐng)、仿制及改劑型申請(qǐng)(ANDA)和補(bǔ)充申請(qǐng),三者占化藥審評(píng)任務(wù)接收量的87.8%。
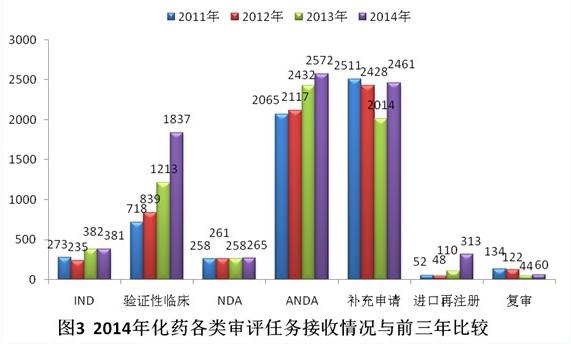
與前三年比較,新藥臨床申請(qǐng)(IND)和新藥上市申請(qǐng)(NDA)接收量相對(duì)平穩(wěn),驗(yàn)證性臨床、ANDA和進(jìn)口再注冊(cè)接收量則增加明顯。具體見圖3。
(2)化藥IND各治療領(lǐng)域接收情況
2014年接收化藥IND申請(qǐng)的治療領(lǐng)域構(gòu)成情況見圖4。
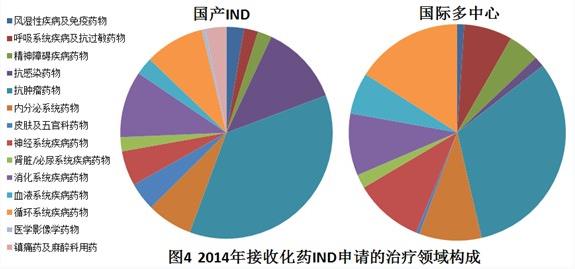
國產(chǎn)IND接收量前五的治療領(lǐng)域分別為:抗腫瘤藥物、抗感染藥物、消化系統(tǒng)疾病藥物、循環(huán)系統(tǒng)疾病藥物、內(nèi)分泌系統(tǒng)藥物。
國際多中心臨床接收量前五的治療領(lǐng)域分別為:抗腫瘤藥物、循環(huán)系統(tǒng)疾病藥物、神經(jīng)系統(tǒng)疾病藥物、消化系統(tǒng)疾病藥物、內(nèi)分泌系統(tǒng)藥物。
(3)化藥重復(fù)申報(bào)情況
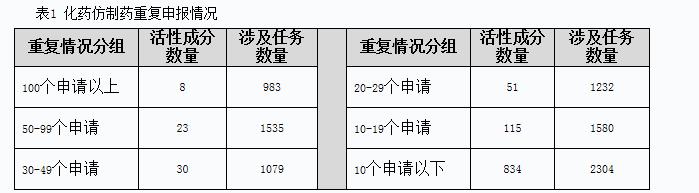
化藥ANDA申請(qǐng)和驗(yàn)證性臨床申請(qǐng)存在大量重復(fù)申報(bào)情況。截至2014年底,待審的化藥ANDA申請(qǐng)共8713個(gè),占待審任務(wù)總量的46.9%,涉及活性成分1061個(gè)。重復(fù)申報(bào)較為嚴(yán)重的有112個(gè)活性成分(相同活性成分品種待審任務(wù)20個(gè)以上),涉及待審任務(wù)4829個(gè),占化藥ANDA總待審任務(wù)量的55.4%。其中相同活性成分品種待審任務(wù)超過100個(gè)的活性成分有:埃索美拉唑、阿托伐他汀鈣、硫酸氫氯吡格雷、恩替卡韋、法舒地爾、頭孢地尼、氨溴索、莫西沙星。具體見表1。

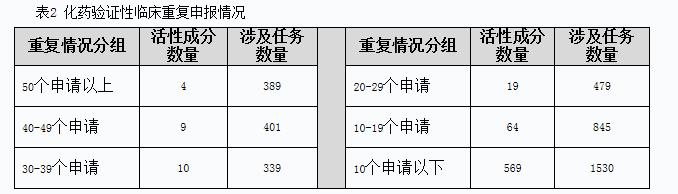
截至2014年底,待審的化藥驗(yàn)證性臨床申請(qǐng)共3983個(gè),占待審任務(wù)總量的21.4%,涉及活性成分675個(gè)。重復(fù)申報(bào)較為嚴(yán)重的有42個(gè)活性成分(相同活性成分品種待審任務(wù)20個(gè)以上),涉及待審任務(wù)1608個(gè),占化藥驗(yàn)證性臨床待審任務(wù)總量的40.4%。其中相同活性成分品種待審任務(wù)超過50個(gè)的活性成分有:阿齊沙坦、羅氟司特、布洛芬(注射劑)、魯拉西酮。具體見表2。

2.中藥審評(píng)任務(wù)接收情況
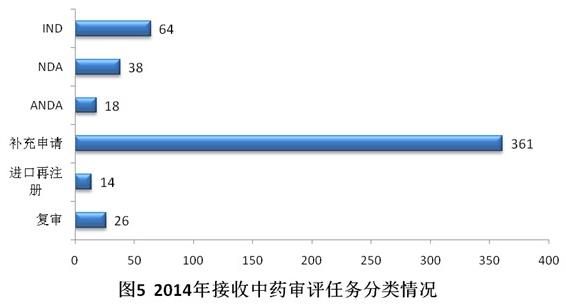
2014年共接收中藥注冊(cè)申請(qǐng)521個(gè),其中69.3%為補(bǔ)充申請(qǐng)。具體見圖5。
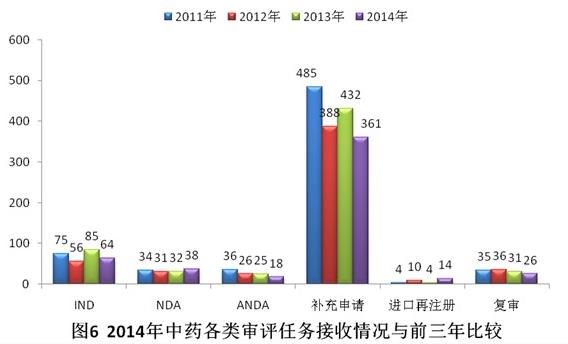
與前三年比較,IND和NDA接收量相對(duì)平穩(wěn),ANDA和補(bǔ)充申請(qǐng)接收量有所下降。具體見圖6。
3.生物制品接收情況
2014年共接收生物制品注冊(cè)申請(qǐng)458個(gè),其中補(bǔ)充申請(qǐng)占49.1%,治療用生物制品IND占32.5%。具體見圖7。
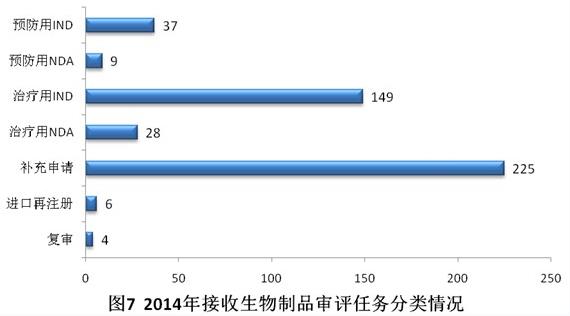
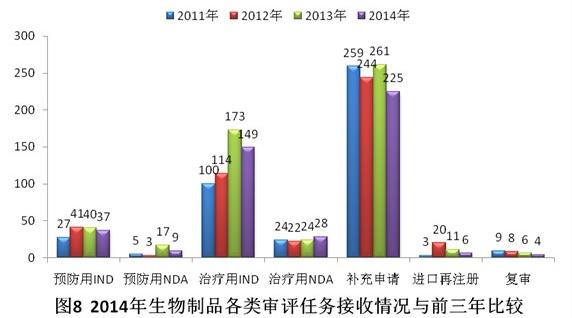
與2013年相比,2014年生物制品除治療用NDA外,其他各類審評(píng)任務(wù)接收量均有所下降。具體見圖8。
(三)審評(píng)任務(wù)完成情況
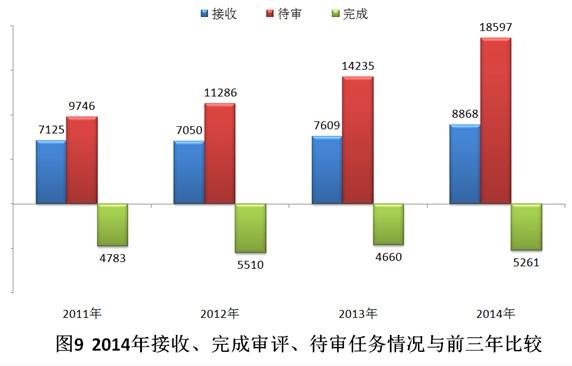
2014年,藥審中心共完成5261個(gè)注冊(cè)申請(qǐng)的技術(shù)審評(píng),比2013年的審評(píng)完成量增加了12.9%,但接收任務(wù)量較2013年增加了16.5%,待審任務(wù)積壓量進(jìn)一步增加。2014年接收、完成審評(píng)、待審任務(wù)情況與前三年比較見圖9。
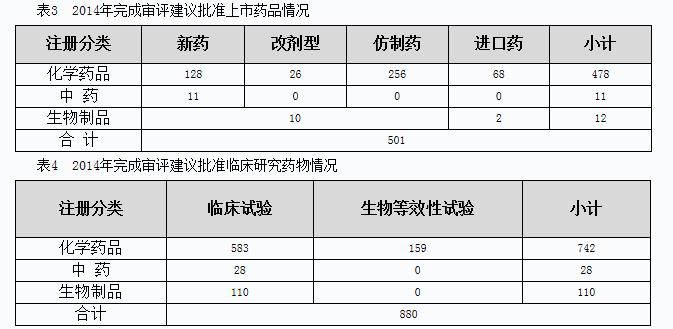
2014年,藥審中心完成審評(píng)建議國家總局批準(zhǔn)上市和批準(zhǔn)臨床研究的情況見表3、表4。
1.化藥審評(píng)完成情況
2014年化藥完成審評(píng)并呈送總局審批的注冊(cè)申請(qǐng)共4091個(gè),另有完成審評(píng)通知現(xiàn)場(chǎng)檢查的注冊(cè)申請(qǐng)156個(gè),完成審評(píng)通知企業(yè)補(bǔ)充資料的注冊(cè)申請(qǐng)625個(gè)。具體情況見表5。
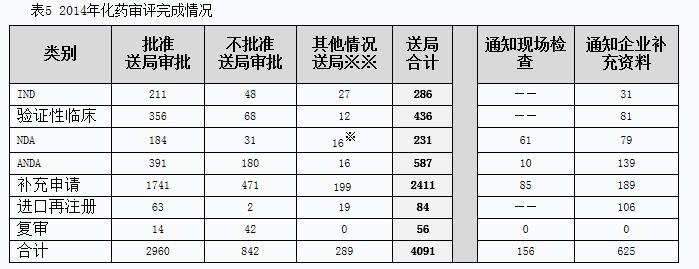
※含完成的3個(gè)藥械組合產(chǎn)品。
※※指企業(yè)申請(qǐng)撤回、非藥審中心審評(píng)事項(xiàng)轉(zhuǎn)局等其他事項(xiàng)。
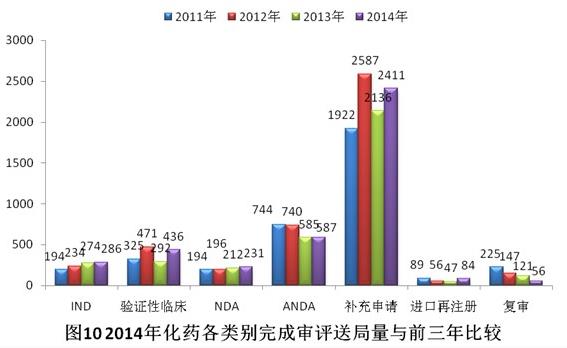
有明確審評(píng)結(jié)論的注冊(cè)申請(qǐng)中,建議批準(zhǔn)的2960個(gè),建議不批準(zhǔn)的842個(gè),總體不批準(zhǔn)率為22.1%。與2013年比較,2014年化藥除復(fù)審?fù)飧黝悇e完成審評(píng)送局量均有所增加。2014年化藥各類別完成審評(píng)送局量與前三年比較情況見圖10。
2.中藥審評(píng)完成情況
2014年中藥完成審評(píng)并呈送總局審批的注冊(cè)申請(qǐng)共647個(gè),另有完成審評(píng)已通知現(xiàn)場(chǎng)檢查的注冊(cè)申請(qǐng)8個(gè),完成審評(píng)通知企業(yè)補(bǔ)充資料的注冊(cè)申請(qǐng)100個(gè)。具體情況見表6。
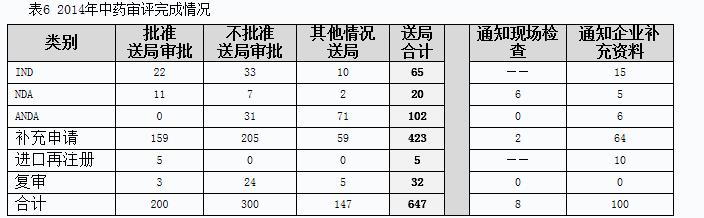
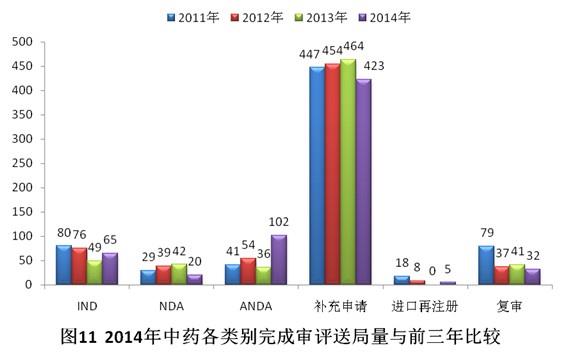
有明確審評(píng)結(jié)論的注冊(cè)申請(qǐng)中,建議批準(zhǔn)的200個(gè),建議不批準(zhǔn)的300個(gè),總體不批準(zhǔn)率為52.5%。2014年中藥各類別完成審評(píng)送局量與前三年比較情況見圖11。
3.生物制品審評(píng)完成情況
2014年完成生物制品審評(píng)并呈送總局審批的注冊(cè)申請(qǐng)共523個(gè),另有完成審評(píng)已通知現(xiàn)場(chǎng)檢查的注冊(cè)申請(qǐng)22個(gè),完成審評(píng)通知企業(yè)補(bǔ)充資料的注冊(cè)申請(qǐng)58個(gè)。具體情況見表7。
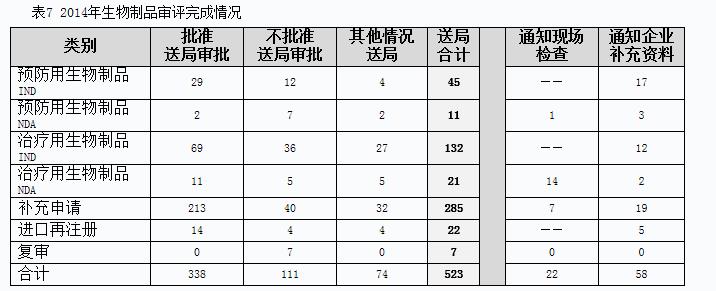
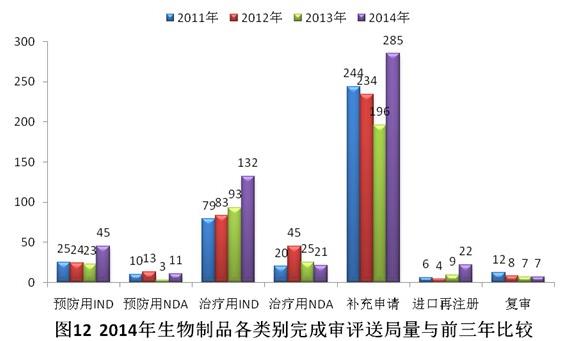
有明確審評(píng)結(jié)論的注冊(cè)申請(qǐng)中,批準(zhǔn)結(jié)論338個(gè),不批準(zhǔn)結(jié)論111個(gè),總體不批準(zhǔn)率為24.7%。2014年生物制品各類別完成審評(píng)送局量與前三年比較情況見圖12。
二、2014年主要工作措施及進(jìn)展
(一)推進(jìn)藥品審評(píng)機(jī)制改革,提升審評(píng)質(zhì)量和效率
做好改革方案制定和改革基礎(chǔ)工作。按照統(tǒng)一部署,積極做好藥品審評(píng)審批制度綜合改革方案的起草制定工作。作為藥品審評(píng)制度改革的主體單位,完成了《技術(shù)審評(píng)管理機(jī)制改革》、《加強(qiáng)技術(shù)審評(píng)能力建設(shè)》等8個(gè)子方案的起草工作。圍繞當(dāng)前審評(píng)工作最突出的審評(píng)任務(wù)積壓矛盾,研究制定了消除審評(píng)任務(wù)積壓三年工作方案。為推進(jìn)藥品審評(píng)審批制度改革,引導(dǎo)社會(huì)投資和醫(yī)藥產(chǎn)業(yè)結(jié)構(gòu)優(yōu)化升級(jí),對(duì)已批準(zhǔn)上市的品種和待審評(píng)的品種進(jìn)行了整理對(duì)比,并對(duì)重復(fù)申報(bào)的藥品注冊(cè)申請(qǐng)進(jìn)行梳理,提供給總局發(fā)布《過度重復(fù)藥品品種目錄》;做好審評(píng)事權(quán)下放的技術(shù)支撐工作,完成了對(duì)29名地方審評(píng)人員的培訓(xùn)工作。
完善鼓勵(lì)藥物創(chuàng)新工作機(jī)制。加快創(chuàng)新藥物臨床試驗(yàn)申請(qǐng)的審評(píng);改革新藥臨床試驗(yàn)申請(qǐng)審評(píng)方式,由原有的以分期批準(zhǔn)臨床試驗(yàn)為主逐漸過渡為一次性批準(zhǔn)臨床試驗(yàn)為主;加強(qiáng)過程風(fēng)險(xiǎn)管控;改進(jìn)了創(chuàng)新藥藥理毒理評(píng)價(jià)的審評(píng)模板;進(jìn)一步完善了創(chuàng)新藥臨床開發(fā)期間以年度報(bào)告方式遞交藥學(xué)研究資料的工作機(jī)制;積極探索中藥創(chuàng)新研發(fā)評(píng)價(jià)的思路和策略。研究建立了“重大新藥創(chuàng)制”重大專項(xiàng)品種的加快審評(píng)機(jī)制。
完成化藥仿制藥“立卷審查”試點(diǎn)工作。通過試點(diǎn)工作的探索實(shí)踐,制定了化藥仿制藥立卷審查標(biāo)準(zhǔn),評(píng)估了立卷審查工作所需的人力資源和時(shí)間成本,探索了如何從受理源頭保證申報(bào)資料質(zhì)量,為后續(xù)實(shí)施藥品注冊(cè)受理機(jī)制改革奠定了基礎(chǔ)。同時(shí),通過試點(diǎn)工作探索了利用立卷審查標(biāo)準(zhǔn)作為快速審評(píng)化藥仿制藥的標(biāo)準(zhǔn),為解決化藥仿制藥審評(píng)任務(wù)積壓矛盾提供了實(shí)踐參考。
優(yōu)化審評(píng)任務(wù)管理。探索審評(píng)計(jì)劃周期長短結(jié)合的任務(wù)管理模式,提高了審評(píng)任務(wù)管理的目標(biāo)性和可預(yù)期性。強(qiáng)化各層級(jí)專業(yè)團(tuán)隊(duì)管理,提高審評(píng)工作的協(xié)調(diào)性。加大上市后補(bǔ)充申請(qǐng)審評(píng)資源的投入,保證已上市品種質(zhì)量改進(jìn)的及時(shí)性,保障公眾用藥。
探索專家網(wǎng)絡(luò)審評(píng)及咨詢工作機(jī)制。通過調(diào)研分析,制定了詳細(xì)工作方案,探索構(gòu)建專家網(wǎng)絡(luò)函審和咨詢系統(tǒng),通過網(wǎng)絡(luò)和信息技術(shù)提高專家咨詢和參與審評(píng)的便捷性,以更加高效地利用專家審評(píng)資源。
(二)清理歷史遺留問題,推進(jìn)解決各種矛盾
對(duì)歷史遺留品種和疑難品種進(jìn)行全面梳理,開展了復(fù)方高血壓藥物、復(fù)方抗生素、抗生素祛痰藥復(fù)方、專利問題品種、涉及《藥品注冊(cè)管理辦法》第72條品種、資料雷同復(fù)審品種,以及莫西沙星、達(dá)托霉素、拉布立海等疑難品種的審評(píng)專題工作,通過和有關(guān)部門進(jìn)行溝通協(xié)調(diào),分析研究審評(píng)處理原則,積極推進(jìn)審評(píng)工作。
(三)加強(qiáng)制度規(guī)范建設(shè),完善技術(shù)標(biāo)準(zhǔn)體系
梳理整合藥審中心已有的200多個(gè)規(guī)章制度,制定了《藥審中心制度建設(shè)三年工作規(guī)劃》和《藥審中心制度建設(shè)2015~2017年工作實(shí)施方案》,有序推進(jìn)中心規(guī)章制度“立、改、廢”。繼續(xù)推動(dòng)技術(shù)指導(dǎo)原則的制定和修訂工作,2014年經(jīng)總局審核發(fā)布12項(xiàng),5項(xiàng)完成上網(wǎng)征求意見。圍繞國際生物類似藥研究進(jìn)展,組織藥審中心各專業(yè)人員及社會(huì)有關(guān)行業(yè)機(jī)構(gòu)起草制定了《生物類似藥研究技術(shù)指導(dǎo)原則》。為推進(jìn)中藥研發(fā)的進(jìn)一步規(guī)范化和科學(xué)化,起草完成了《中藥新藥治療惡性腫瘤臨床研究技術(shù)指導(dǎo)原則》征求意見稿,已上網(wǎng)征求意見。啟動(dòng)了《化藥新藥臨床試驗(yàn)一般指導(dǎo)原則》的撰寫工作,并已完成初稿。
(四)積極推進(jìn)用人機(jī)制改革,全面加強(qiáng)人才隊(duì)伍建設(shè)
拓寬渠道增加審評(píng)力量,全年新招聘事業(yè)編審評(píng)人員10人,完成了首批聘用制審評(píng)員招聘試點(diǎn)工作。從相關(guān)技術(shù)單位和省局借調(diào)技術(shù)人員37人,協(xié)助開展審評(píng)工作。積極探索購買服務(wù),與北京藥學(xué)會(huì)等單位合作抽調(diào)專家協(xié)助開展立卷審查試點(diǎn)工作,與法律專業(yè)機(jī)構(gòu)合作組成律師團(tuán)隊(duì)。充分利用社會(huì)資源,推動(dòng)藥品審評(píng)社會(huì)共治體系建設(shè),與北京大學(xué)第一醫(yī)院、中國藥科大學(xué)、沈陽藥科大學(xué)簽署合作框架協(xié)議,增強(qiáng)審評(píng)工作的開放性,促進(jìn)審評(píng)人才隊(duì)伍建設(shè)。
(五)繼續(xù)完善審評(píng)質(zhì)量保障體系,保證審評(píng)質(zhì)量
繼續(xù)實(shí)施并完善專家咨詢會(huì)制度。專家咨詢會(huì)制度是審評(píng)質(zhì)量保障體系的重要組成部分。2014年,藥審中心在完善咨詢專家?guī)臁⒏倪M(jìn)專家聘請(qǐng)模式、強(qiáng)化專家會(huì)紀(jì)律、完善專家咨詢會(huì)操作規(guī)程等方面取得了長足進(jìn)步。全年共集中召開專家咨詢會(huì)議11次,其他單獨(dú)品種或指導(dǎo)原則等專題咨詢會(huì)43次,共涉及177個(gè)品種,邀請(qǐng)專家1736人次。
做好世衛(wèi)組織NRA再評(píng)估工作。2014年4月,世衛(wèi)組織對(duì)我國疫苗國家監(jiān)管體系(簡稱NRA)進(jìn)行再次評(píng)估,與首次評(píng)估相比,再評(píng)估標(biāo)準(zhǔn)提高,評(píng)估內(nèi)容更完整。根據(jù)世衛(wèi)組織NRA評(píng)估工作要求和總局NRA工作整體部署,落實(shí)好組織籌備工作。在世衛(wèi)組織專家檢查期間,做好上市許可(MA)板塊的各項(xiàng)現(xiàn)場(chǎng)迎檢工作,并獲得高分評(píng)估,為我國順利通過NRA再評(píng)估提供了有力支撐。
推進(jìn)審評(píng)質(zhì)量體系建設(shè)及ISO9001認(rèn)證工作。2014年藥審中心疫苗審評(píng)質(zhì)量管理體系再次順利通過監(jiān)督審核,獲得確認(rèn)證書。同時(shí),根據(jù)藥品審評(píng)審批制度改革要求,將審評(píng)質(zhì)量管理工作從疫苗體系,擴(kuò)大到覆蓋中藥、化藥和生物制品的全中心質(zhì)量管理體系,進(jìn)一步明確了藥品審評(píng)質(zhì)量管理目標(biāo),制定了《藥審中心建立藥品審評(píng)質(zhì)量管理體系工作實(shí)施方案》,積極采用購買服務(wù)方式,借助外部專業(yè)機(jī)構(gòu),構(gòu)建藥審中心審評(píng)質(zhì)量管理體系。
進(jìn)一步加強(qiáng)信息化建設(shè)。完成了符合信息化發(fā)展規(guī)律的技術(shù)審評(píng)系統(tǒng)升級(jí)工作,為實(shí)現(xiàn)審評(píng)人員數(shù)量擴(kuò)增以及多地點(diǎn)、多種途徑開展審評(píng)工作提供了有效的信息化支持,提高了信息技術(shù)對(duì)審評(píng)工作質(zhì)量的保障水平;推進(jìn)信息標(biāo)準(zhǔn)化體系建設(shè),利用數(shù)字化手段促進(jìn)審評(píng)標(biāo)準(zhǔn)的科學(xué)性和審評(píng)尺度的一致性,提高審評(píng)質(zhì)量和效率;做好信息系統(tǒng)安全等級(jí)保護(hù)工作,通過公安部測(cè)評(píng),符合國家信息安全等級(jí)保護(hù)第三級(jí)要求,提高了中心網(wǎng)絡(luò)及系統(tǒng)的安全防護(hù)水平。
三、2014年批準(zhǔn)重要治療領(lǐng)域藥品情況
2014年,經(jīng)過藥審中心的審評(píng),提出建議批準(zhǔn)以下多個(gè)重要治療領(lǐng)域的藥品上市,為患者獲得最新治療手段提供了可能性,也為患者用藥可及性提供了重要保障。
(一)抗腫瘤用藥
1.甲磺酸阿帕替尼片 我國自主研發(fā)的首個(gè)血管內(nèi)皮細(xì)胞生長因子受體(VEGFR)抑制劑,也是全球首個(gè)批準(zhǔn)用于治療晚期胃癌的小分子靶向產(chǎn)品。胃癌是我國高發(fā)腫瘤,晚期胃癌二線化療失敗后目前尚無公認(rèn)的有效治療選擇,存在迫切臨床需求。該產(chǎn)品的上市,對(duì)胃癌患者的治療提供了新的用藥選擇。
2.西達(dá)本胺片 我國自主研發(fā)的首個(gè)組蛋白去乙酰化酶抑制劑,也是國內(nèi)首個(gè)批準(zhǔn)用于治療復(fù)發(fā)難治的外周T細(xì)胞淋巴瘤的藥物。復(fù)發(fā)難治的外周T細(xì)胞淋巴瘤缺乏有效治療,預(yù)后差,該產(chǎn)品上市對(duì)復(fù)發(fā)難治外周T細(xì)胞淋巴瘤治療提供了新的治療機(jī)會(huì)。
3.多西他賽注射液 紫杉醇類化療藥,微管解聚抑制劑,已在我國批準(zhǔn)用于乳腺癌、非小細(xì)胞肺癌,以及非激素依賴的前列腺癌的患者。現(xiàn)國內(nèi)批準(zhǔn)增加晚期胃癌的新適應(yīng)癥,為胃癌患者的治療提供了新的用藥選擇。
4.鹽酸帕洛諾司瓊注射液 5-羥色胺3(5-HT3)受體的競爭性拮抗劑,已在我國批準(zhǔn)用于預(yù)防腫瘤患者因化療引起的惡心和嘔吐。現(xiàn)國內(nèi)批準(zhǔn)增加用于預(yù)防術(shù)后24小時(shí)惡心嘔吐的新適應(yīng)癥,為外科手術(shù)患者提供了預(yù)防術(shù)后惡心嘔吐的新治療手段。
(二)疫苗領(lǐng)域
5.Sabin株脊髓灰質(zhì)炎滅活疫苗(sIPV) 我國自主研發(fā)的全球首個(gè)Sabin株脊髓灰質(zhì)炎滅活疫苗(單苗),填補(bǔ)了我國在脊髓灰質(zhì)炎滅活疫苗生產(chǎn)領(lǐng)域的空白,消除了目前計(jì)劃免疫規(guī)劃中數(shù)千萬劑使用的口服脊髓灰質(zhì)炎減毒活疫苗潛在的致病危險(xiǎn)(疫苗株或衍生株引發(fā)的相關(guān)病例),安全性更好。藥審中心按特殊審批程序完成了該疫苗上市注冊(cè)申請(qǐng)的審評(píng),有效配合了WHO全球根除脊髓灰質(zhì)炎病毒的行動(dòng)計(jì)劃。同時(shí),該疫苗的批準(zhǔn)上市,對(duì)我國乃至全球,特別是發(fā)展中國家消滅脊髓灰質(zhì)炎都會(huì)產(chǎn)生積極的影響。
(三)內(nèi)分泌系統(tǒng)用藥
6.鹽酸西那卡塞片 本品被批準(zhǔn)用于治療慢性腎臟病維持性透析患者的繼發(fā)性甲狀旁腺功能亢進(jìn)癥。目前我國僅批準(zhǔn)了帕立骨化醇注射液用于治療接受血液透析的慢性腎功能衰竭患者的繼發(fā)性甲狀旁腺功能亢進(jìn),給藥途徑為靜脈注射。本品是我國批準(zhǔn)用于治療該疾病的首個(gè)口服藥物,為此類患者提供了一個(gè)新的治療手段。
(四)眼科用藥
7.曲伏噻嗎滴眼液 本品被批準(zhǔn)用于降低成人開角型青光眼或高眼壓癥患者升高的眼壓,適用于β受體阻滯劑或前列腺素類似物局部治療效果不佳者。本品較現(xiàn)有治療有更優(yōu)的治療后24小時(shí)藥物谷底降眼壓效應(yīng),并可減少眼部充血不良事件的發(fā)生,有效拓展了該疾病領(lǐng)域的用藥選擇空間。
(五)消化系統(tǒng)用藥
8.復(fù)方苦參結(jié)腸溶膠囊 新的中藥復(fù)方制劑,被批準(zhǔn)用于治療輕、中度潰瘍性結(jié)腸炎(活動(dòng)期),中醫(yī)辨證屬于濕熱內(nèi)蘊(yùn)者。潰瘍性結(jié)腸炎是傳統(tǒng)中醫(yī)藥治療的優(yōu)勢(shì)病種。本品即繼承了傳統(tǒng)中醫(yī)藥理論,又通過現(xiàn)代制藥技術(shù)將釋藥部位定位在結(jié)腸,其批準(zhǔn)上市為潰瘍性結(jié)腸炎患者提供了新的治療手段。
(六)心血管系統(tǒng)用藥
9.注射用重組人組織型纖溶酶原激活劑TNK突變體(rhTNK-tPA) 國產(chǎn)替奈普酶(TNK-tPA)制劑,為天然tPA的改構(gòu)體,屬于第三代纖維蛋白特異性溶栓劑,被批準(zhǔn)用于急性心肌梗死癥狀發(fā)作6小時(shí)內(nèi),伴持續(xù)ST段抬高或新近出現(xiàn)左束支傳導(dǎo)阻滯的心肌梗死患者的溶栓治療。與先前已經(jīng)在國內(nèi)外上市的alteplase(阿替普酶,rt-PA)相比,具有對(duì)新產(chǎn)生的血凝塊溶解作用更強(qiáng)、對(duì)纖溶酶原活化劑抑制因子I(PAI-I)有抵抗力、更高的纖溶特異性、更長的半衰期、給藥方式更加簡單、單次彈丸式靜脈注射給藥即可完成溶栓治療、方便院外溶栓、縮短心肌再灌注的時(shí)間等優(yōu)點(diǎn)。同品種已經(jīng)在美國和歐盟獲得上市,國產(chǎn)品種的批準(zhǔn)上市顯著提高了我國患者的用藥可及性。
(七)生殖系統(tǒng)用藥
10.國產(chǎn)西地那非片 治療陰莖勃起功能障礙(ED)的主流藥物,由于專利保護(hù)致使市場(chǎng)壟斷,長期以來進(jìn)口原研品種在國內(nèi)銷售價(jià)格昂貴。2014年在原研廠家的西地那非片專利到期之際,審評(píng)批準(zhǔn)了國產(chǎn)西地那非片的生產(chǎn)上市許可,將有效提升國內(nèi)ED患者的用藥選擇空間。
(八)麻醉與鎮(zhèn)痛用藥
11.鹽酸右美托咪定注射液 一種選擇性α2腎上腺素能受體激動(dòng)劑,已在我國批準(zhǔn)用于行全身麻醉的手術(shù)患者氣管插管和機(jī)械通氣時(shí)的鎮(zhèn)靜。現(xiàn)國內(nèi)批準(zhǔn)增加用于重癥監(jiān)護(hù)期間開始插管和使用呼吸機(jī)病人的鎮(zhèn)靜的新適應(yīng)癥,為國內(nèi)重癥監(jiān)護(hù)病人的鎮(zhèn)靜提供了新的用藥選擇。
(九)抗風(fēng)濕用藥
12.然降多吉膠囊 新的藏藥復(fù)方制劑,被批準(zhǔn)用于治療藏醫(yī)真布(類風(fēng)濕關(guān)節(jié)炎),藏醫(yī)辨證為濕痹寒濕阻絡(luò)證,癥見關(guān)節(jié)疼痛、關(guān)節(jié)腫脹、晨僵。西藏屬于類風(fēng)濕類疾病高發(fā)的高寒地區(qū),傳統(tǒng)藏醫(yī)藥對(duì)類風(fēng)濕性關(guān)節(jié)炎(藏醫(yī)稱真布)積累了豐富的經(jīng)驗(yàn),類風(fēng)濕性關(guān)節(jié)炎是藏醫(yī)藥治療的優(yōu)勢(shì)病種。本品是根據(jù)知名藏醫(yī)藥專家經(jīng)驗(yàn)方研制的現(xiàn)代藏藥新藥,其批準(zhǔn)上市為類風(fēng)濕性關(guān)節(jié)炎的治療提供了新的治療選擇。
四、結(jié)語
在黨的十八屆三中、四中全會(huì)精神指引下,在國家食品藥品監(jiān)督管理總局的堅(jiān)強(qiáng)領(lǐng)導(dǎo)下,藥審中心將繼續(xù)深化推進(jìn)改革,認(rèn)真履行職責(zé),積極做好藥品技術(shù)審評(píng)工作,切實(shí)維護(hù)和促進(jìn)公眾健康。
來源:國家食品藥品監(jiān)督管理局藥品審評(píng)中心



 1568
1568  2015-03-18
2015-03-18  Back
Back


